Le paludisme
Faits saillants
- Le paludisme est une cause importante de morbidité et de mortalité, particulièrement chez les enfants de moins de cinq ans qui habitent en Afrique subsaharienne.
- En 2018, le paludisme a été responsable d’environ 405 000 décès de par le monde et d’un nombre estimatif de 228 millions de cas de cette maladie.
- Il n’est pas recommandé de procéder au dépistage systématique des immigrants et des réfugiés asymptomatiques qui arrivent au Canada.
- Il faut présumer le paludisme chez une personne fiévreuse qui a vécu ou voyagé dans une région où la maladie est endémique, surtout si ce séjour s’est produit au cours des trois mois précédents. Les symptômes du paludisme peuvent être non spécifiques (fièvre, céphalées, malaises) et prendre la forme d’une grave maladie de type grippal.
- La simple présence de fièvre chez une personne qui arrive d’une région endémique suffit pour justifier à des examens diagnostiques du paludisme.
- Le paludisme est une urgence médicale. Il est essentiel de le diagnostiquer rapidement. Le retard de diagnostic et de traitement peut se révéler mortel.
- Pour diagnostiquer le paludisme, on utilise un frottis sanguin (étalement mince et goutte épaisse) ou des tests de diagnostic rapide.
- Il est important de prévenir le paludisme chez les enfants et leur famille qui rendent visite à des amis et des parents dans des régions endémiques. Les meilleures mesures protectrices consistent à utiliser des antipaludiques bien choisis, des insectifuges et des moustiquaires imprégnées d’insecticides.
L’épidémiologie et les facteurs de risque
Le paludisme est une maladie fébrile associée à un taux de morbidité et de mortalité élevé chez les enfants des tropiques, particulièrement en Afrique subsaharienne, en Asie et, moins souvent, dans certaines régions d’Amérique centrale et d’Amérique du Sud.
En 2018, près de la moitié de la population mondiale était vulnérable au paludisme. Cette année-là, on a recensé 228 millions de cas et environ 405 000 décès causés par cette maladie. De ce nombre, 67 % étaient des enfants de moins de cinq ans, et 94 % se sont déclarés dans la région africaine.1
On ne sait pas combien de jeunes néo-canadiens sont atteints du paludisme. Les enfants de 19 ans et moins sont peut-être surreprésentés; ils représentent 23 % des cas déclarés à l’Agence de la santé publique du Canada (1998-2008), mais seulement 8,7 % des travailleurs internationaux (2011).2 Sur les 195 cas de paludisme grave ou compliqué déclarés au Réseau canadien sur le paludisme entre 2001 et 2012, 21,1 % s’étaient produits chez des enfants, dont la majorité était d’origine étrangère.2
Envisagez un diagnostic de paludisme chez un patient qui a une maladie fébrile et qui a vécu ou voyagé dans une région endémique au paludisme (figure 1).
Figure 1 : Incidence mondiale de P. falciparium
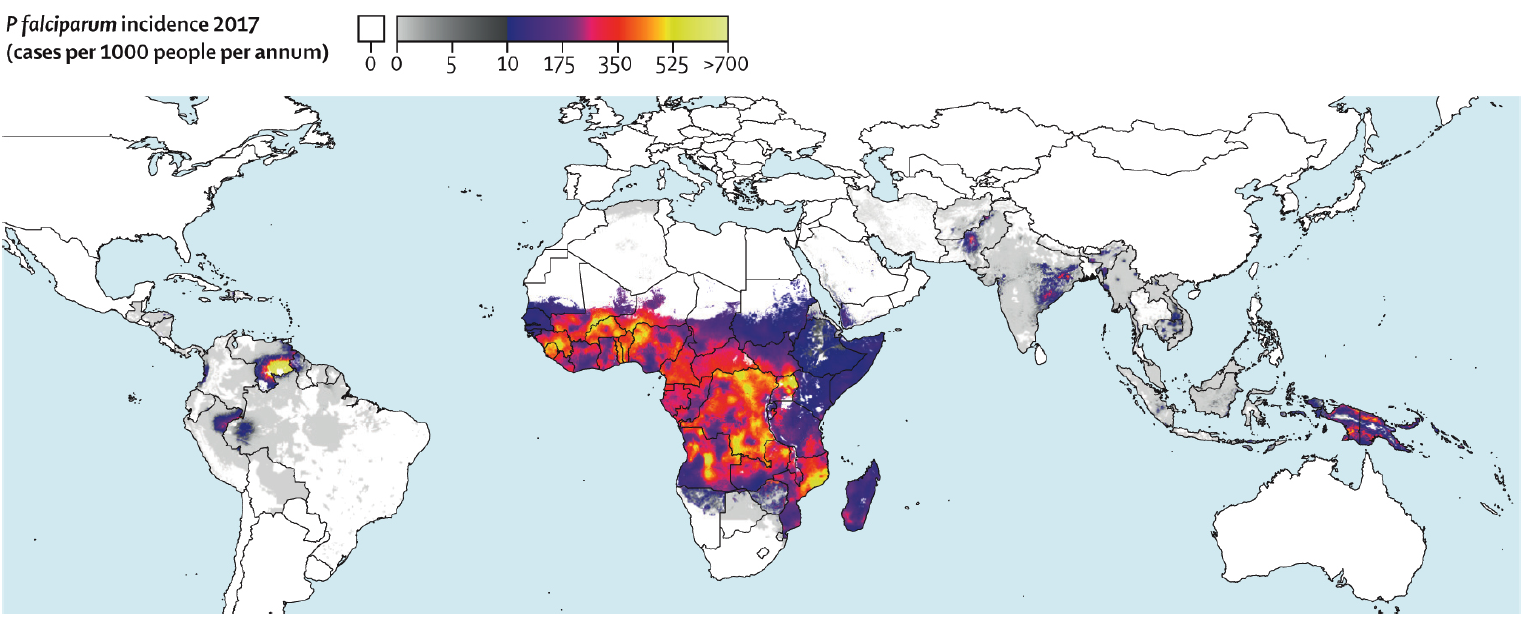 Extrait de Weiss et coll.3
Extrait de Weiss et coll.3
L’étiologie
Sept espèces de parasites du paludisme sont responsables de la maladie chez les humains : le Plasmodium falciparum (le plus virulent), le P. vivax, le P. malariæ, le P. ovale curtisi, le P. ovale wallikeri, le P. knowlesi et le P. simium. La transmission s’effectue surtout par la piqûre de moustiques anophèles femelles infectés et, dans une moindre mesure, par les transfusions sanguines à cause de l’utilisation d’aiguilles et de seringues infectées, ainsi que par la mère à l’enfant par le placenta (le nouveau-né est alors atteint de paludisme congénital).
Les périodes d’incubation varient considérablement et dépendent largement de l’espèce de paludisme :
- P. falciparum : De deux semaines à trois mois après la dernière exposition. La majorité se déclare au cours du mois suivant la dernière exposition.
- P. vivax, P. ovale ou P. malariæ : Un an ou plus après l’exposition. Des rechutes causées par le P. vivax et le P. ovale se produisent parfois plus d’un an après la primo-infection.
- P. knowlesi : On ne connaît pas la période d’incubation du P. knowlesi.
La présence d’une simple fièvre chez une personne provenant d’une région endémique suffit pour faire des examens en vue de déceler le paludisme.
Les indices cliniques
Le paludisme se caractérise par l’apparition soudaine de frissons, d’épisodes de rigidité musculaire et de fièvre pouvant atteindre 106 °F (41 °C). Les patients peuvent également souffrir de nausées, de diarrhée, d’arthralgies, de céphalées et de delirium. Les signes connexes incluent une hypotension posturale, de l’anémie, une hépatosplénomégalie, un ictère, des maux de ventre et de dos.
Des paroxysmes de fièvre et de frissons, souvent suivis de sueurs, se manifestent généralement à intervalles de 48 heures en cas de P. vivax, de P. ovale et de P. falciparum, et à intervalles de 72 heures en cas de P. malariæ. Cependant, en l’absence de traitement antipaludique, il faut parfois attendre un certain nombre de jours avant que ce schéma devienne apparent en cas de P. falciparum. Le paludisme peut prendre la forme d’une grave maladie de type grippal.
Le paludisme à P. falciparum grave ou compliqué
Le paludisme grave ou compliqué se définit comme un paludisme aigu accompagné de taux élevés de parasitémie (plus de 2 %) ou de manifestations de dysfonctionnement des organes cibles. Les complications du paludisme sont résumées ci-dessous.
La mortalité peut dépasser les 20 % à 30 % en cas de paludisme grave causé par le P. falciparum. Des trois syndromes cliniques classiques associés au paludisme chez les enfants (la détresse respiratoire, le paludisme cérébral et l’anémie sévère), la détresse respiratoire est responsable du taux de mortalité le plus élevé.4
Chez un patient ayant une parasitémie à P. falciparum asexué sans autre cause évidente de symptômes, la présence d’au moins une caractéristique clinique ou un résultat de laboratoire parmi ceux qui figurent ci-dessous permet de classer le patient parmi ceux qui sont atteints de paludisme grave.
|
Manifestation clinique |
|
Test de laboratoire |
|---|---|---|
|
Prostration et troubles de la conscience |
|
Anémie sévère (hématocrite < 15 %; Hb ≤ 50 g/L) |
|
Détresse respiratoire |
|
Hypoglycémie (glycémie < 2,2 mmol/L) |
|
Convulsions multiples |
|
Acidose (pH artériel < 7,25 ou bicarbonate < 15 mmol/L) |
|
Collapsus cardiovasculaire |
|
Insuffisance rénale (créatinine > 265 µmol/L) |
|
Œdème pulmonaire (radiologique) |
|
Hyperlactacidémie |
|
Saignements anormaux |
|
Hyperparasitémie |
|
Jaunisse |
|
≥ 2 % des enfants de moins de 5 ans* |
|
Hémoglobinurie |
|
≥ 5 % des adultes et enfants de 5 ans ou plus non immunisés# ≥ 10 % chez les adultes et les enfants de 5 ans ou plus partiellement vaccinés# |
|
*Certains jeunes enfants atteints d’une parasitémie (dont plus de 2 % à 5 % ont souffert de plusieurs infections paludiques antérieures, ne respectent aucun autre critère de paludisme grave et sont maintenus en observation à l’hôpital) peuvent être candidats à un traitement à l’atovaquone-proguanil s’ils peuvent être suivis de près; un traitement parentéral peut leur être offert si leur état de santé évolue. #Les personnes non vaccinées sont celles qui sont nées dans des pays où le paludisme n’est pas endémique ou dans des régions où la transmission est faible, telles que les voyageurs. De plus, ceux qui ont déjà vécu dans un secteur où le paludisme est endémique sont considéres comme ayant perdu leur immunité après une période où ils ne sont pas exposés au paludisme (au moins six à 12 mois hors de la zone endémique). Les personnes partiellement immunisées sont nées ou ont longtemps résidé dans un pays où le paludisme est endémique et ont eu des épisodes antérieurs de paludisme. Adapté des Directives pour le traitement du paludisme, 2015. Organisation mondiale de la Santé. Source : Comité consultatif de la médecine tropicale et de la médecine des voyages (CCMTMV). 2019. Recommandations canadiennes pour la prévention et le traitement du paludisme (malaria) chez les voyageurs internationaux.2 |
||
Il est à souligner que la prostration et la détresse respiratoire sont des caractéristiques courantes chez les enfants, tandis que l’œdème pulmonaire et l’insuffisance rénale se manifestent davantage chez les adultes.
Le paludisme non falciparum
Le P. vivax et (rarement) le P. ovale peuvent également être responsables d’un grave paludisme, la détresse respiratoire en étant généralement la principale manifestation. Puisque les cycles de vie du P. vivax et du P. ovale incluent une phase hépatique latente (l’hypnozoïte), ces espèces peuvent s’associer à des récidives plusieurs semaines à plusieurs années après l’infection initiale. La partie intitulée Le traitement antipaludique contient de l’information sur le traitement visant à éviter les récidives.
Le P. malariæ est peu fréquent au Canada. Il se présente souvent sous forme d’espèce co-infectieuse, mais il s’associe à un syndrome néphrotique dans les cas chroniques observés dans les pays endémiques. Le P. knowlesi est un agent pathogène émergent dont le portrait clinique ressemble à celui du P. falciparum, mais se rapproche davantage du P. malariæ au microscope.
On peut également observer une co-infection, par le P. falciparum et le P. vivax, par exemple.
Les facteurs déterminants pour la survie des patients sont un diagnostic précoce et un traitement approprié. La plupart des infections et des décès attribuables au paludisme sont évitables.2
Le diagnostic
Lorsque le paludisme fait partie du diagnostic différentiel, il faut obtenir un diagnostic rapide et précis en laboratoire, surtout s’il y a une possibilité d’infection à P. falciparum d’après les voyages antérieurs.
Le paludisme est une urgence médicale. S’il est impossible d’obtenir des services diagnostiques rapides, il faut consulter un infectiologue ou un spécialiste de la médecine tropicale afin d’obtenir des recommandations sur la prise en charge aiguë.
Le diagnostic au moyen d’un frottis sanguin
Pour diagnostiquer le paludisme, la plupart des centres font appel à des frottis sanguins (étalement mince et goutte épaisse) colorés au Giemsa :
- La goutte épaisse favorise la concentration du sang, de manière que les parasites peu présents soient plus faciles à repérer.
- L’étalement mince permet de déterminer les espèces et de quantifier la parasitémie.
- Un seul frottis peut donner un résultat faussement négatif de présence du parasite du paludisme. Compte tenu de la nature cyclique de la parasitémie paludique, si les symptômes persistent, il faut reprendre le frottis sanguin (ou les tests de diagnostic rapide) toutes les 12 à 24 heures, au moins deux autres fois avant d’éliminer le paludisme comme cause de la fièvre.2
Les tests de diagnostic rapide (TDR)
Il existe diverses trousses d’analyse pour déceler les antigènes dérivés de globules rouges lysés impaludés. Les tests de diagnostic rapide (TDR), qui font appel à une petite quantité de sang obtenue par ponction au bout du doigt ou à du sang traité à l’anticoagulant, donnent des résultats dans un délai de cinq à 20 minutes et sont très sensibles. Ces TDR représentent un ajout utile et rapide et peuvent remplacer la microscopie, surtout lorsqu’il est impossible d’obtenir un diagnostic fiable à la microscopie. Puisque la limite inférieure habituelle pour déceler la maladie est de 100 parasites de P. falciparum par microlitre de sang, le frottis peut être positif malgré un TDR négatif. Puisque la plupart des trousses permettent seulement de distinguer les espèces falciparum des espèces non falciparum, le frottis sanguin demeure impératif pour établir la spéciation des cas non P. falciparum et pour quantifier la parasitémie.
Dans certains centres, on offre d’autres tests diagnostiques, tels que l’amplification en chaîne par polymérase (PCR), qui sont très sensibles.
Les autres tests
Les autres tests sont :
- Un hémogramme avec numération leucocytaire différentielle et une numération plaquettaire. La thrombocytopénie est l’anomalie précoce la plus courante. Le paludisme provoque une hémolyse et peut s’associer à une anémie qu’on n’observe pas nécessairement au début de la maladie. Pendant les épisodes de rigidité musculaire, la numération leucocytaire peut être élevée, tandis qu’autrement, elle est généralement normale ou faible.
- le test à l’urée et le taux de créatinine. Les résultats peuvent être élevés en raison de la déshydratation ou d’une atteinte rénale.
- les tests de fonction hépatique, y compris la bilirubine. Ils peuvent être élevés en raison de l’hémolyse ou d’une insuffisance organique.
- un test glycémique, qui peut être faible, puisque les enfants atteints de paludisme sont très vulnérables à l’hypoglycémie, surtout s’ils sont traités à la quinine.
- des hémocultures. Chez les enfants surtout, le diagnostic différentiel peut inclure un sepsis, une pneumonie bactérienne ou une méningite. Même si les bactéries entériques (notamment la Salmonella) prédominent dans la plupart des essais, diverses bactéries sont observées dans le sang de patients qui ont également reçu un diagnostic de paludisme.
Le traitement
Règle générale, tous les enfants atteints d’un paludisme à P. falciparum symptomatique devraient être hospitalisés. Il faut également envisager l’hospitalisation des patients atteints d’autres formes de paludisme, surtout s’ils ne tolèrent pas les médicaments par voie orale. Puisque le paludisme ne se transmet pas d’une personne à l’autre, il n’est pas nécessaire de les mettre en isolement.
- Si le médecin traitant n’a pas d’expérience dans le traitement du paludisme, il doit immédiatement consulter un infectiologue ou un spécialiste de la médecine tropicale.
- S’il n’y a pas de compétences locales dans le traitement des patients atteints de paludisme, l’Agence de la santé publique du Canada diffuse une liste de médecins du Canada qui participent au Réseau canadien sur le paludisme et peuvent fournir des conseils sur la prise en charge des cas.
Les médicaments antipaludiques
Pour obtenir plus d’information sur des recommandations précises au sujet de traitements antipaludiques, y compris les médicaments, les doses et les contre-indications, il suffit de consulter les ouvrages suivants :
- Recommandations canadiennes pour la prévention et le traitement du paludisme (malaria) – 2019, publié par l’Agence de la santé publique du Canada;
- Malaria Treatment (United States), 2020. Centres for Disease Control and Prevention (CDC) des États-Unis.
- Guidelines for the treatment of malaria, 3e édition, 2015. Organisation mondiale de la Santé.
Le traitement antipaludique
Le choix des médicaments varie selon l’espèce de parasite du paludisme, la gravité de la maladie, la région d’acquisition (en raison des profils de résistance) et les facteurs liés à l’hôte.
En cas de P. falciparum non compliqué, les isolats sont résistants à la chloroquine dans la plupart des régions du monde, à l’exception du nord-ouest du canal de Panama, des îles des Antilles et de quelques régions d’Asie. Consultez l’annexe du CCMTMV pour obtenir de l’information géographique sur le paludisme résistant aux médicaments. Les polythérapies à l’artémisine ne sont pas encore homologuées au Canada. C’est pourquoi on prescrit généralement de l’atovaquone-proguanil ou de la quinine par voie orale associée à un autre médicament.
Le paludisme grave, même s’il n’est pas courant au Canada, est en augmentation depuis quelques années. Au total, 367 cas, dont 103 enfants (28 %), ont dû recevoir un traitement par intraveineuse (sous forme d’artésunate ou de quinine) du Réseau canadien sur le paludisme entre 2014 et 2017. La principale raison invoquée pour le voyage était une visite à des amis et à des parents. Notamment, les enfants représentaient 22 % des voyageurs rendant visite à des amis et à des parents et 71 % des cas touchaient de récents immigrants.6 Dans le cas d’une maladie à P. falciparum grave ou compliquée, dont le taux de mortalité s’élève à 20 % ou plus, les enfants devraient être transférés de toute urgence à un centre où l’on possède de l’expérience dans la prise en charge de cette maladie, et de préférence à l’un des centres du Réseau canadien sur le paludisme où l’on entrepose de l’artésunate par voie intraveineuse en vertu du Programme d’accès spécial. L’infectiologue ou le spécialiste de la médecine tropicale peut recommander d’amorcer un premier médicament par voie orale ou intraveineuse (s’il est disponible) avant le transfert. Lisez davantage sur l’accès médical à l’artésunate ou à la quinine par l’entremise du Réseau canadien sur le paludisme.
Le profil de résistance du P. vivax varie. Dans la plupart des cas, la chloroquine est efficace, mais dans certaines régions, l’émergence d’une résistance oblige l’utilisation d’autres antipaludiques. Il est conseillé aux praticiens de s’entretenir avec un pédiatre consultant en infectiologie ou en médecine tropicale pour déterminer la thérapie adaptée au cas. La chloroquine est efficace contre le P. ovale et le P. malariæ, quelle que soit la région d’acquisition. Le P. knowlesi est également sensible à la chloroquine. Cependant, en présence d’une maladie grave, il faudrait le traiter au moyen d’une thérapie intraveineuse, tout comme le P. falciparum grave.
Dans les cas de paludisme causés par le P. vivax ou le P. ovale, après le traitement de la maladie aiguë, il faut administrer aux patients qui ne présentent pas de déficit congénital en glucose-6-phosphate déshydrogénase (G6PD) lié au sexe un traitement de deux semaines à la primaquine afin d’éradiquer les hypnozoïtes hépatiques et de prévenir les récidives de paludisme aigu. Il est important de procéder au dépistage sanguin du déficit en G6PD avant de prescrire de la primaquine, car les personnes qui en sont porteuses risquent une hémolyse si on leur administre ce médicament. La prévalence de déficit en G6PD varie, mais elle peut atteindre 30 % dans certains bagages génétiques. Si une mère allaitante reçoit un diagnostic de paludisme à P. vivax ou à P. ovale, il faut dépister déficit en G6PD tant chez la mère que chez le bébé allaité, afin de déterminer si la primaquine est contre-indiquée.
Si on diagnostique un déficit en G6PD chez un patient ayant un P. vivax ou un P. ovale ou si ce patient présente une récidive, le praticien devrait consulter un infectiologue ou un spécialiste de la médecine tropicale.
Les traitements de soutien peuvent inclure les éléments suivants :
- L’acétaminophène contre la fièvre
- Le glucose pour prévenir ou traiter l’hypoglycémie
- Les liquides pour prévenir ou traiter la déshydratation
- La transfusion sanguine pour soigner une anémie sévère
- Les anticonvulsivants contre les convulsions
- L’exsanguinotransfusion, qui peut sauver la vie si le patient est atteint d’un paludisme à P. falciparum compliqué ou une hyperparasitémie
- Les antibiotiques à large spectre en cas de paludisme grave pour traiter une bactériémie concomitante éventuelle
L’élaboration d’un vaccin antipaludique
Il n’y a pas encore de vaccin homologué pour prévenir le paludisme. Les objectifs à long terme d’un tel vaccin consistent à assurer une protection contre le paludisme clinique et à en réduire la transmission.
Un essai de phase 3 du vaccin à la circumsporozoïtaire du nom de RTS,S/AS01 (RTS,S) a été réalisé de 2009 à 2014 dans sept pays africains, et environ 15 500 nourrissons et jeunes enfants y ont participé. Le vaccin RTS,S a réduit de 39 % les épisodes de paludisme et de 31,5 % les épisodes de grave palusdisme.3
Puisque ce grand essai aléatoire et contrôlé a eu une modeste efficacité, le programme d’adoption du vaccin contre le paludisme coordonné par l’Organisation mondiale de la Santé est en cours de projet pilote à grande échelle dans trois pays (Ghana, Malawi et Kenya).
L’importance de l’éducation sanitaire et de la sensibilisation
Le diagnostic et le traitement efficaces peuvent tarder chez les néo-immigrants et les néo-réfugiés au Canada pour diverses raisons, dont les suivantes :
- Accès facile à des antipaludiques dans leur pays d’origine
- Utilisation de remèdes traditionnels ou d’antipaludiques achetés à l’étranger qui peuvent être inefficace, inférieurs aux normes ou contrefaits
- Difficulté d’accès au système de santé canadien
- Manque d’argent pour payer les antipaludiques
- Frustration quant au fait qu’il est souvent compliqué d’obtenir une évaluation et un traitement du paludisme au Canada par rapport au pays d’origine, qui s’associe à une mauvaise compliance
Les obstacles au diagnostic et au traitement rapides du paludisme au Canada s’établissent comme suit :
- Le manque de sensibilisation des dispensateurs de soins à l’occurrence, à la gravité, au diagnostic pertinent et au traitement efficace de cette maladie
- La disponibilité limitée des diagnostics du paludisme ou la lenteur à les obtenir dans certaines régions
- La non-disponibilité de l’artémisinine par voie orale au Canada
Les professionnels de la santé doivent penser davantage au paludisme lors du diagnostic différentiel d’un enfant ou d’un adolescent qui a vécu ou voyagé dans une région où la maladie est endémique, surtout si c’est au cours des trois mois précédents. En sensibilisant les professionnels de la santé à cette maladie, on contribuera à prévenir une morbidité et une mortalité inutiles chez les immigrants et réfugiés très vulnérables nouvellement arrivés au Canada.
La prévention
Il est important de prévenir le paludisme chez les enfants et les familles qui rendent visite à des amis et des parents dans des régions endémiques. Parmi les mesures protectrices, soulignons la prophylaxie à l’aide de médicaments antipaludiques pertinents, achetés au Canada, et l’utilisation d’insectifuge et de moustiquaires imprégnées d’insecticide. La prévention du paludisme chez les voyageurs est abordée dans le module sur les maladies des voyageurs.
L’élaboration d’un vaccin antipaludique
Il n’y a pas encore de vaccin homologué pour prévenir le paludisme. Les objectifs à long terme d’un tel vaccin consistent à assurer une protection contre le paludisme clinique et à en réduire la transmission.
Les résultats d’une grande étude sur un vaccin contre le P. falciparum ont été publiés en 2011.3 L’étude de phase 3, l’étude en cours la plus avancée sur un vaccin contre le paludisme, porte sur 15 460 enfants. D’après l’issue primaire de l’analyse publiée en 2011, on constatait l’efficacité du vaccin contre le paludisme clinique 12 mois après la vaccination chez 56 % des 6 000 premiers enfants de 5 à 17 mois. L’efficacité signifie une réduction de la fréquence de paludisme clinique chez les enfants vaccinés, mais pas une protection complète chez la moitié des enfants. On ne connaît pas encore la durée de la protection et s’il faudra administrer des doses de rappel.
Quelques ressources
- Recommandations canadiennes pour la prévention et le traitement du paludisme (malaria) – CCMTMV. Agence de la santé publique du Canada, 2019.
- Malaria and Travellers for U.S. Residents, 2020. Centres for Disease Control and Prevention (CDC)
- Global Malaria Programme. Organisation mondiale de la Santé.
- Pottie K, Greenaway C, Feightner J et coll. Evidence-based clinical guidelines for immigrants and refugees. CMAJ 2011;183(12):E824-925. Consulter l’annexe 9 : Malaria: Evidence review for newly arriving immigrants and refugees.
Références
- Organisation mondiale de la Santé. Rapport 2019 sur le paludisme dans le monde, 2019. Genève, Suisse: OMS, 2019.
- Agence de la santé publique du Canada. Recommandations canadiennes pour la prévention et le traitement du paludisme (malaria) – 2019.
- Weiss DJ, Lucas TCD, Nguyen M et coll. Mapping the global prevalence, incidence, and mortality of Plasmodium falciparum, 2000-17: a spatial and temporal modelling study. Lancet. 2019;394(10195):322-31. doi:10.1016/S0140-6736(19)31097-9.
- Marsh K, Forster D, Waruiru C et coll. Indicators of life-threatening malaria in African children. N Engl J Med. 1995;332(21):1399-404. doi:10.1056/NEJM199505253322102
- RTS,S Clinical Trials Partnership. Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. Lancet 2015;386:31-45.
- McCarthy A, Carson S, Ampaw P, Sarfo S, Geduld J. Severe malaria in Canada 2014-2017: report from the Canadian Malaria Network. Int J Infect Dis 2019;79(s1):15. doi.org/10.1016/j.ijid.2018.11.054
Réviseuse scientifique
Heather Onyett, MD
Michael Hawkes, MD
Susan Kuhn, MD
Mise à jour : février, 2023
