Les infections gastro-intestinales parasitaires chez les enfants immigrants et réfugiés
Faits saillants
- Les infections par la Giardia, les géohelminthiases (des vers) (p. ex., les nématodes[Ascaris], les trichocéphales [Trichuris] et les ankylostomes) et les parasites des espèces Strongyloides et Schistosoma font partie des infections fréquentes dans les populations de réfugiés.
- Souvent asymptomatiques ou subcliniques, elles peuvent également être responsables d’une morbidité importante et même de décès.
- Des tests diagnostiques sont recommandés chez les enfants en cas d’inquiétude clinique d’infection (symptômes gastro-intestinaux, retard de croissance, éruptions chroniques, anémie, éosinophilie). L’évaluation microscopique d’œufs et de parasites dans les selles n’est pas toujours sensible; c’est pourquoi il est nécessaire d’effectuer de multiples prélèvements sur des jours différents. Dans le cas de certaines infections, les tests sérologiques ou les analyses moléculaires dans les selles sont recommandés.
- Il est recommandé d’utiliser des tests sérologiques pour dépister des infections helminthiques à Strongyloides et Schistosoma chez les enfants réfugiés et immigrants qui arrivent de régions endémiques. Si les résultats sont positifs, le traitement est recommandé même si les enfants sont asymptomatiques, car ces infections peuvent avoir de graves conséquences sur la santé à long terme.
Aperçu
Les enfants sont prédisposés aux infections gastro-intestinales parasitaires en raison de leurs environnements extérieurs, du contact étroit avec d’autres enfants et de comportements développementaux contraires à l’hygiène. Les enfants nouveaux arrivants peuvent y être plus susceptibles, en fonction de l’épidémiologie de leur pays d’origine et de leur parcours migratoire, notamment s’ils ont vécu dans des milieux surpeuplés, dans de mauvaises conditions sanitaires ou en institution.
La plupart des infections gastro-intestinales parasitaires sont asymptomatiques chez les personnes en bonne santé. Elles peuvent toutefois être responsables d’une morbidité gastro-intestinale et extra-intestinale importante. Les infections chroniques par des vers peuvent être responsables d’atteintes organiques à long terme, de maladies au potentiel mortel découlant d’une immunosuppression iatrogène ou de séquelles neurodéveloppementales.
Le présent article passe en revue plusieurs infections parasitaires fréquentes et importantes sur le plan clinique, réparties selon la structure suivante :
- Protozoaires : parasites unicellulaires
- Helminthes : vers, qui peuvent être sous-divisés comme suit :
- Vers ronds (nématodes)
- Douves (trématodes)
- Ténias (cestodes)
Les infections gastro-intestinales à protozoaires
La plupart des protozoaires gastro-intestinaux se propagent par transmission féco-orale ou interhumaine ou par des aliments ou de l’eau contaminés. En général, les infections symptomatiques se manifestent par de la diarrhée. La fièvre est inhabituelle.
La giardiase : La Giardia est l’infection parasitaire intestinale la plus courante dans le monde (1). De nombreuses infections sont asymptomatiques. La Giardia peut provoquer une diarrhée aiguë autorésolutive ou une diarrhée chronique. Les gonflements, les nausées, l’anorexie, les douleurs abdominales, la stéatorrhée, la malabsorption, le retard de croissance et l’anémie peuvent s’y associer. Les symptômes peuvent fluctuer. La fièvre, les diarrhées sanglantes, les manifestations extra-intestinales et l’éosinophilie sont atypiques.
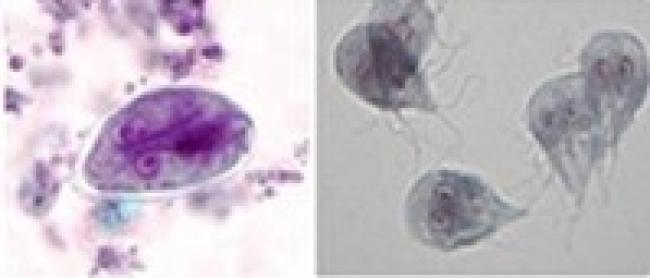
Figure 1. Kyste Giardia et trophozoïtes
Source : Centers for Disease Control and Prevention, DDx, giardiase
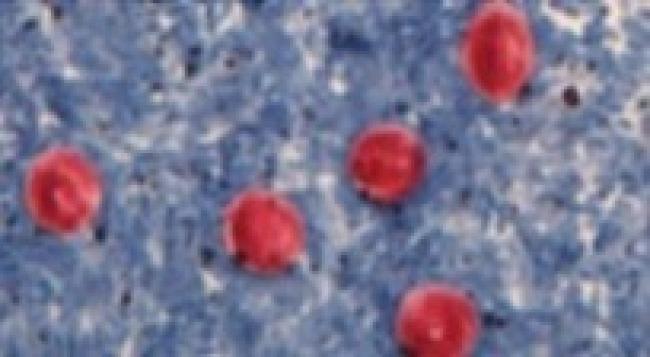
Figure 2. Oocystes de Cryptosporidium
Source : Centers for Disease Control and Prevention, DDx, Cryptosporidiose
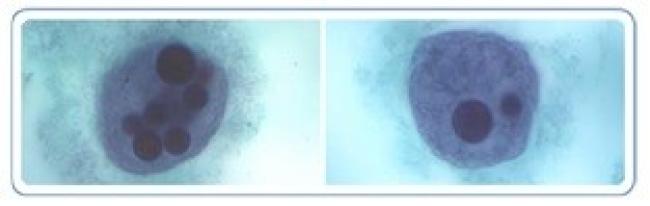
Figure 3. Trophozoïtes d’E. histolytica avec érythrophagocytose
Source : Centers for Disease Control and Prevention, DPDx, Amibiase
La cryptosporidiose : Le Cryptosporidium, qui est présent partout dans le monde, est une cause importante de maladie diarrhéique chez l’enfant (2). Il peut être contracté par contact avec des animaux (3). Les enfants peuvent être asymptomatiques ou avoir des diarrhées aqueuses autorésolutives. La diarrhée peut devenir prolongée, grave ou même fatale chez les jeunes enfants ou les personnes immunodéprimées (p. ex., VIH/sida) (4). La fièvre, les vomissements, la perte de poids ou la déshydratation y sont associés, de même que les maladies respiratoires ou biliaires chez les personnes immunodéprimées. L’infection à Cryptosporidium est liée à la malnutrition, même en l’absence de diarrhée (5).
L’amibiase : Des millions de personnes sont infectées par l’Entamoeba histolytica. Ce parasite est responsable d’un nombre estimatif de 50 000 décès chaque année, particulièrement en Asie du Sud, en Afrique subsaharienne, en Amérique centrale et en Amérique du Sud (6). La plupart des infections intestinales sont asymptomatiques. Cependant, certaines évoluent vers la douleur abdominale, la perte de poids, les diarrhées liquides ou la dysenterie (diarrhée contenant du mucus ou du sang). L’évolution, qui peut être aiguë ou chronique, alterne parfois entre la diarrhée et la constipation et peut imiter une maladie inflammatoire de l’intestin. Les rares complications intestinales incluent l’hémorragie gastro-intestinale, les sténoses, la colite nécrosante et la perforation, accompagnée d’un risque de décès. Les maladies extra-intestinales se manifestent chez une faible proportion de patients, généralement sous forme d’abcès hépatique, et se propagent parfois dans l’espace pleural, les poumons, le péricarde ou le cerveau. Bien qu’elle soit rare chez les enfants, une rupture d’abcès peut être fatale (7). Le cycle de vie de l’Entamoeba histolytica est présenté dans le site Web des CDC, en anglais.
Le diagnostic
L’évaluation microscopique des œufs et des parasites (O et P) dans les selles pour identifier les trophozoïtes ou les kystes est la méthode diagnostique standard des infections protozoaires gastro-intestinales. Puisque la sensibilité de l’évaluation des O et P est limitée par l’excrétion intermittente des parasites dans les selles, de deux ou trois prélèvements de selles devraient être effectués sur des jours différents (1). Dans une étude auprès de 1 042 adoptés internationaux touchés par des parasites gastro-intestinaux (surtout protozoaires), la sensibilité d’une seule évaluation des O et P s’élevait à 79 %, tandis que deux ou trois prélèvements faisaient passer la sensibilité à 92 % et à 100 %, respectivement (8). Si la présence d’un parasite donné est soupçonnée en fonction de l’épidémiologie ou de l’évaluation clinique, le nom du parasite devrait être indiqué sur le formulaire, car cette observation pourrait inciter le laboratoire de microbiologie à effectuer un test de dépistage spécialisé supplémentaire.
Il existe des dosages d’amplification en chaîne de la polymérase (PCR) multiplex dans les selles pour dépister les protozoaires, qui permettent d’obtenir des résultats rapides, ont une sensibilité élevée et sont souvent supérieurs à l’évaluation microscopique dans les selles (9).
L’E. histolytica est difficile à détecter à l’évaluation microscopique dans les selles (sensibilité de 25 % à 60 %) et, sur le plan morphologique, est identique à des espèces Entamoeba commensales non pathogènes. La PCR dans les selles et la détection des antigènes sont préférables (10). La sérologie de l’E. histolytica par immunodosage enzymatique peut être utilisée comme test adjuvant. Elle a une sensibilité de 95 % pour l’amibiase extra-intestinale et de 70 % pour l’infection gastro-intestinale active, mais seulement de 10 % pour la colonisation asymptomatique, et elle ne peut distinguer une infection active d’une infection antérieure (7). L’échographie, la tomodensitométrie et l’imagerie par résonance magnétique peuvent révéler des abcès hépatiques et d’autres foyers extra-intestinaux de l’infection à E. histolytica.
Le traitement
Le traitement antiparasitaire recommandé des infections protozoaires gastro-intestinales est exposé au tableau 1. En général, il est indiqué si les symptômes sont importants ou prolongés ou si les hôtes sont vulnérables (p. ex., personnes immunodéprimées). Cependant, l’infection à E. histolytica devrait toujours être traitée, même chez les personnes asymptomatiques, en raison du risque d’infection invasive ou de transmission à des contacts étroits (7).
La giardiase peut être récurrente en raison d’une résistance aux médicaments, d’une réinfection ou de l’immunodéficience de l’hôte. La polythérapie peut être plus efficace dans ces cas (11).
Le dépistage des protozoaires chez les nouveaux arrivants symptomatiques
- On peut envisager le dépistage d’O et P dans les selles chez les enfants nouveaux arrivants asymptomatiques. L’American Academy of Pediatrics recommande de deux à trois évaluations des O et P dans les selles (y compris des évaluations propres à la Giardia et au Cryptosporidium) pour les migrants provenant de régions aux ressources limitées ou qui sont dans une situation défavorisée sur le plan socioéconomique (12) et qui sont des adoptés internationaux (13). Les directives de 2011 de la Collaboration canadienne pour la santé des immigrants et des réfugiés ne contiennent pas cette recommandation (14).
Certains recommandent le dépistage de l’E. histolytica avant d’administrer des corticostéroïdes aux personnes qui présentent des facteurs de risque de colonisation, afin de prévenir l’évolution vers une colite fulminante (10, 15).
|
Tableau 1. Traitements suggérés en cas d’infection par des protozoaires pathogènes (16) |
|
|---|---|
Parasite intestinal |
Traitement proposé pour les enfants et les adolescents |
|
Amibiase |
Infection asymptomatique
En cas de colite ou d’abcès hépatique SUIVIS d’iodoquinol ou de paromomycine, comme il est indiqué ci-dessus, afin d’éliminer les kystes. |
Cryptosporidiose
|
Les piliers de la prise en charge sont les soins de soutien et l’optimisation de la fonction immunitaire. Le traitement pharmacologique est généralement réservé chez les hôtes immunodéprimés ou en cas de symptômes prolongés.
|
Cyclosporose
|
Triméthoprime (TMP)/sulfaméthoxazole (SMX) : 8 à 10 mg/kg/jour de l’élément TMP PO divisés bid x 7 à 10 jours |
|
Giardiase |
|
Cystoisosporose
|
Triméthoprime (TMP)/sulfaméthoxazole (SMX) : 8 à 10 mg/kg/jour de TMP IV ou PO divisés bid x 7 à 10 jours |
|
*Le métronidazole sous forme liquide n’est peut-être pas appétissant pour les enfants. Les comprimés peuvent être écrasés et mélangés dans un semi-solide comme de la compote de pommes. Consulter un pharmacien au besoin. **Le nitazoxanide n’est pas homologué au Canada, mais est disponible par l’entremise du Programme d’accès spécial de Santé Canada. Il doit être pris avec des aliments. |
|
Les helminthiases gastro-intestinales
Des millions de personnes dans le monde sont infectées par des helminthes gastro-intestinaux. La transmission, qui se produit par ingestion, pénétration cutanée ou inoculation vectorielle d’œufs ou de larves, est associée aux climats chauds, à de mauvaises conditions sanitaires et à la pauvreté. Le tableau clinique peut varier considérablement en fonction des agents pathogènes et des caractéristiques de l’hôte.
A. Les vers ronds intestinaux (nématodes)

Figure 4. Œufs Ascaris et vers femelle adulte
Source : Orange County Public Health Laboratory, Santa Ana, Californie. Utilisation autorisée.

Figure 5. Œuf de Trichuris (trichocéphale) et ver femelle adulte
Source : Centers for Disease Control and Prevention, DPDx, Public Health Image Library (PHIL): phil.cdc.gov
Les nématodes intestinaux sont également appelés helminthes transmis par le sol. Les vers adultes logent dans le système digestif humain. Les espèces les plus pertinentes sur le plan clinique sont l’Ascaris lumbricoides (gros vers ronds), le Trichuris trichiura (trichocéphale) et les espèces d’Ancylostoma et de Necator (ankylostomes). [Le Strongyloides stercoralis est abordé plus loin.] Ils sont très répandus dans les régions tropicales et subtropicales.
La plupart des pathologies associées à ces espèces sont liées à la charge parasitaire, qui diminue lorsqu’une personne quitte une région endémique puisque les vers adultes ont une durée de vie relativement courte (de quelques mois à quelques années). Les personnes qui ont une faible charge parasitaire sont généralement asymptomatiques. Lorsque les charges sont plus élevées, les symptômes habituels incluent les douleurs ou les distensions abdominales, les nausées, la diarrhée, les malaises, la malabsorption, la malnutrition et le retard de croissance qui en découle, de même que l’anémie chronique qui, à son tour, peut compromettre le développement physique et cognitif de l’enfant. Il arrive que ces helminthiases entraînent des complications qui justifient une intervention chirurgicale (p. ex., occlusion intestinale ou biliaire attribuable à l’Ascaris, un prolapsus rectal causé par le Trichuris).
Le diagnostic
Il faut effectuer au moins deux évaluations microscopiques d’O et P dans les selles, au moyen d’un prélèvement effectué deux jours différents et déposé dans un agent de préservation (17). Le pays d’origine et tout soupçon d’helminthes particuliers doivent être précisés sur le formulaire. Il existe des dosages PCR des helminthes, mais ils ne sont généralement pas disponibles au Canada.
Le traitement
Les infections à nématode doivent être traitées à l’aide d’anthelminthiques, comme il est exposé au tableau 2.
Mention spéciale : le Strongyloides stercoralis
Le Strongyloides stercoralis est un helminthe transmis par le sol à la biologie particulière, qui doit faire l’objet d’une approche différente. Il est très endémique dans les régions tropicales, subtropicales et tempérées. De 30 à 100 millions de personnes dans le monde sont atteintes d’une infection chronique, mais il s’agit probablement d’une sous-estimation (18). L’infection à Strongyloides est fréquente chez les migrants vers des régions à faible prévalence, leur séroprévalence globale s’élevant à 12,2 % et les taux les plus élevés étant observés chez les migrants des régions du Pacifique, de l’Afrique subsaharienne, de l’Amérique latine et des Caraïbes (19).
Le site Web des CDC donne un aperçu du cycle de vie du Strongyloides, en anglais. Pour résumer, les larves infectieuses pénètrent dans la peau à partir du sol contaminé, puis migrent vers les poumons. Après avoir remonté l’arbre trachéo-bronchique, les larves sont avalées et deviennent des vers adultes dans le grêle. Les œufs sont produits et excrétés dans le système digestif, puis se développent pour devenir des larves qui retournent au sol pour compléter le cycle de vie. Cependant, les larves peuvent réinfecter l’hôte par le côlon ou la région périanale. Cette capacité d’« auto-infection » peut entraîner une infection permanente, même après la migration de régions endémiques.
Les caractéristiques gastro-intestinales de l’infection à Strongyloides incluent des douleurs abdominales non spécifiques (généralement épigastriques), des brûlures d’estomac, des ballonnements, des nausées, des vomissements, de la diarrhée (qui peut alterner avec de la constipation), de l’anorexie et d’une malabsorption (20).
La strongyloïdose peut toucher d’autres systèmes (20, 21) :
- Systémique : Fièvres, perte de poids, retard de croissance chez les enfants
- Pulmonaire : Pneumonite transitoire (pseudosyndrome de Löffler) pendant la migration des larves dans les poumons (rare)
- Dermatologique : Papules prurigineuses transitoires au foyer de la pénétration cutanée; urticaire intermittente ou « larva currens » (cordons érythémateux serpigineux et prurigineux dans la région périanale, sur les fesses et sur le haut des cuisses).
La plupart des infections à Strongyloides sont asymptomatiques. L’éosinophilie (>500/mL) peut être la seule anomalie visible, mais ce n’est pas un marqueur sensible.
L’infection à Strongyloides clinique ou subclinique peut persister pendant des années ou des décennies. Le cycle d’auto-infection peut s’accélérer en raison des corticostéroïdes, d’autres immunosuppresseurs, d’un cancer ou d’une co-infection par le HTLV-1. Il peut alors provoquer un syndrome d’hyperinfection, de nombreuses larves migrant dans l’estomac et les poumons, et être associé à des infiltrats pulmonaires et une détresse respiratoire. L’évolution comporte la distribution des vers adultes par la circulation systémique aux autres organes, y compris le cerveau, le foie, le cœur et la peau. Une méningite ou un sepsis concomitants accompagnés de bacilles entériques à Gram négatif est courant, car les bactéries quittent le système digestif conjointement avec les larves. L’hyperinfection et la maladie disséminée sont reliées à des taux de mortalité de plus de 50 % dans des séries de cas (22).
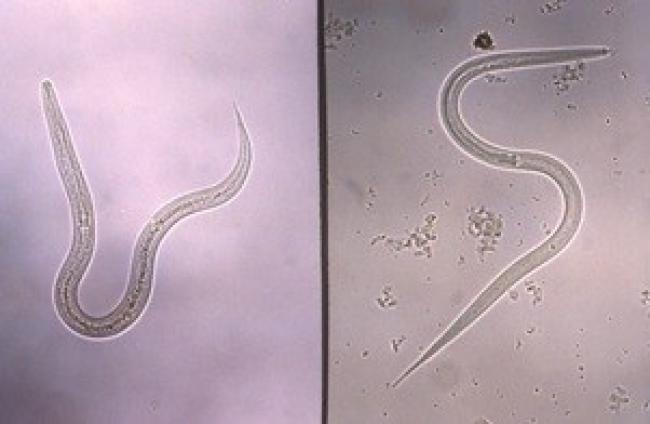
Figure 6. Larves filariformes d’ankylostome (à gauche) et de Strongyloides (à droite) au stade infectieux
Source : Centers for Disease Control and Prevention, Public Health Image Library (PHIL), docteure Mae MelvIn : phil.cdc.gov/phil
Le diagnostic
Un immigrant ou un réfugié qui provient d’une région endémique aux Strongyloides et qui présente des caractéristiques cliniques de strongyloïdose devrait être soumis à un test de dépistage. L’excrétion de larves à Strongyloides dans les selles a une qualité diagnostique, mais est peu sensible, car elle exige de nombreux prélèvements et des techniques de concentration spécialisées (20). Les tests sérologiques sont favorisés, en raison de leur sensibilité plus élevée (23). La spécificité (réaction croisée avec d’autres helminthiases) et la sensibilité (réduite chez les hôtes immunodéprimés) de la sérologie sont limitées. Des échantillons d’O et P dans les selles doivent également être prélevés chez les personnes immunodéprimées. Si on soupçonne une hyperinfection ou une dissémination, il faut procéder à l’évaluation microscopique des O et P dans d’autres liquides corporels (p. ex., expectorations, liquide céphalorachidien).
Le traitement
Il est recommandé de consulter un infectiologue pédiatre ou un spécialiste de la médecine tropicale avant d’amorcer le traitement.
L’ivermectine est le traitement de première intention de la strongyloïdose. Le traitement à l’albendazole ou au thiabendazole est associé à de plus faibles taux de guérison (24), et n’est donc recommandé que si l’ivermectine est contre-indiquée. La combinaison d’ivermectine et d’albendazole est utilisée en cas d’hyperinfection ou de dissémination (23). L’innocuité de l’ivermectine n’est pas officiellement confirmée chez les enfants de moins de 15 kg, mais selon des données rétrospectives, ce traitement est sécuritaire et bien toléré (25). Avant d’entreprendre le traitement à l’ivermectine, il faut écarter une co-infection par la loase chez les personnes des régions endémiques (23).
Il peut être nécessaire d’administrer des traitements prolongés ou répétés en cas d’hyperinfection ou de strongyloïdose disséminée, et les récidives sont possibles. Dans ce cas, des antibiotiques à large spectre sont indiqués pour traiter des complications bactériennes secondaires somme le sepsis ou la méningite.
|
Tableau 2. Traitements suggérés en cas d’infection par des vers ronds intestinaux (nématodes) (16) |
|
|---|---|
Parasite intestinal |
Traitement suggéré pour les enfants et les adolescents |
|
Vers ronds |
|
|
|
|
Ankylostomes |
|
|
Strongyloïdose |
|
Trichocéphale
|
|
|
* Non homologué au Canada, mais disponible par l’entremise du Programme d’accès spécial de Santé Canada |
|
B. Les douves (trématodes)
Les douves ont un cycle de vie qui transite par un hôte intermédiaire, les escargots d’eau douce, qui déterminent la répartition géographique de chaque espèce. Les douves du sang pénètrent par la surface de la peau pour infecter les humains, tandis que les douves d’origine alimentaire infectent les humains lors de l’ingestion de certains aliments. Puisqu’ils envahissent les tissus, tous les trématodes ont tendance à être responsables d’une éosinophilie.
La schistosomiase (« bilharziose »)
La schistosomiase est une maladie parasitaire aiguë et chronique causée par les douves du sang du genre Schistosoma, divisées en six espèces pathogènes. On estime que plus de 250 millions de personnes sont infectées par la schistosomiase dans le monde. La schistosomiase est endémique dans diverses régions tropicales et subtropicales (figure 7), mais plus de 80 % des cas sont observés en Afrique subsaharienne. Chaque année, on estime que la schistosomiase est responsable de 12 000 décès (26) et de 1,6 million d’années de vie ajustée en fonction de l’incapacité perdues (27). Chez les migrants des régions endémiques, une analyse systématique a établi une séroprévalence de Schistosoma de 18,4 %, les taux les plus élevés (24,1 %) étant observés chez les migrants d’Afrique subsaharienne (19).
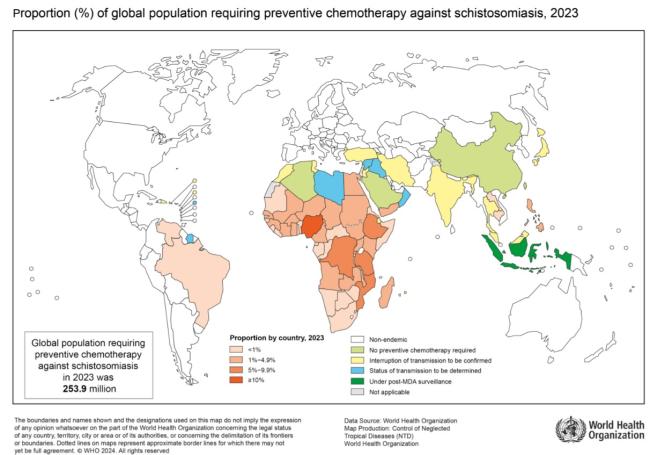
Figure 7. La répartition géographique de la schistosomiase
Source :Distribution of schistosomiasis, 2003. Organisation mondiale de la Santé, 2024. Licence : CC BY-NC-SA 3.0 IGO
Le site Web des CDC contient plus d’information sur la schistosomiase, en anglais. Pour résumer, les personnes sont infectées lorsque des formes larvaires du parasite, libérées par des escargots d’eau douce, pénètrent dans la peau. Les larves accèdent à la circulation sanguine et migrent des poumons aux plexus veineux qui drainent les intestins (S. mansoni et S. japonicum) ou la vessie (S. haematobium). Ils s’y développent alors en vers adultes qui vivent une moyenne de trois à dix ans (28). Les vers femelles produisent des centaines de milliers d’œufs par jour. Certains sont excrétés dans les selles ou l’urine, mais d’autres sont bloqués dans les tissus corporels comme la paroi intestinale, le foie et la vessie et sont responsables de réactions inflammatoires et d’une fibrose évolutive.
Le risque de symptômes et de complications est corrélé par l’intensité de l’exposition et la quantité de vers. La plupart des enfants atteints de schistosomiase intestinale sont asymptomatiques. En présence d’inflammation intestinale, les enfants peuvent souffrir de douleurs abdominales, d’anorexie, de diarrhée (parfois sanglante), d’entéropathie par perte de protéines, de carence en fer ou de retard de croissance. L’inflammation hépatique peut être responsable d’une hépatomégalie qui, si elle n’est pas traitée, peut évoluer en fibrose périportale, en hypertension portale, en splénomégalie, en ascites et en varices œsophagiennes. Le fonctionnement hépatocellulaire est généralement préservé jusqu’au stade avancé de la maladie, la bilirubine et les enzymes hépatiques demeurant normaux (29). Il est maintenant établi que même un faible nombre de vers est associé à une anorexie, à une sous-alimentation, à l’anémie et à une atteinte du développement (30).
Les autres manifestations de la schistosomiase s’établissent comme suit : (28, 31)
- La schistosomiase aiguë (maladie de Katayama) : Réaction d’hypersensibilité systémique lorsque les vers femelles commencent à produire des œufs, de deux à 12 semaines après l’exposition. Elle se manifeste généralement chez les personnes non immunisées (p. ex., les voyageurs), sous forme de fièvre, de malaises, d’éruptions, de lymphadénopathie, de toux, d’anorexie, de douleurs abdominales, de diarrhée sanglante, l’hépatosplénomégalie sensible et l’éosinophilie. La résolution se produit généralement au bout de deux à quatre semaines, mais il y a également des décès.
- L’atteinte urogénitale : L’inflammation de la vessie prend généralement la forme d’une hématurie. Au fil du temps, la fibrose de la paroi vésicale peut être responsable d’un reflux urinaire, d’une hydronéphrose, d’infections urinaires récurrentes, d’un syndrome néphrotique, de calculs vésicaux, d’un cancer de la vessie et d’insuffisance rénale. La schistosomiase urogénitale est un facteur de risque d’infertilité et d’infection par le VIH.
- L’atteinte dermatologique : Lors de la pénétration initiale des larves par la peau, on peut constater une éruption papulaire prurigineuse et transitoire (une « dermatite cercarienne »). Des éruptions urticariennes chroniques sont également possibles.
- L’atteinte hématologique : Anémie ou inflammation chronique, éosinophilie
- L’atteinte neurologique : Convulsions ou myélite transverse (rare)
Le diagnostic
Le diagnostic définitif de schistosomiase est posé lors de la détection d’œufs dans les prélèvements de selle ou d’urine par évaluation microscopique, mais la sensibilité de cette méthode est limitée en raison de l’excrétion intermittente d’œufs, notamment lors d’infections légères (28). Il est recommandé de prélever trois échantillons de selle (si la personne a été exposée au S. mansoni ou au S. japonicum) ou dans trois échantillons d’urine (en cas d’exposition au S. haematobium) lors de trois jours différents. L’excrétion d’œufs dans l’urine est plus susceptible d’être positive à la fin de l’évacuation, entre midi et 15 h (31).
Les tests sérologiques peuvent être utiles pour détecter des infections plus légères, mais elles sont peu sensibles à certaines espèces de Schistosoma et leur spécificité est imparfaite en raison de leur réaction croisée avec d’autres helminthes. Par ailleurs, elles ne peuvent distinguer une infection active d’une infection passée. Il existe des tests de détection des antigènes et des tests PCR dans l’urine et le sang, mais ils ne sont pas disponibles partout au Canada.
Une fois l’infection à Schistosoma diagnostiquée, le patient doit subir une évaluation pour démontrer la présence de la maladie (32). Pour ce faire, il faut procéder à une échographie du foie pour détecter une fibrose et une hypertension portale, de même qu’une analyse des urines et une échographie du système urinaire chez les migrants d’Afrique subsaharienne ou du Moyen-Orient susceptibles d’avoir été exposés au S. hematobium. En cas de soupçon de neuroschistosomiase, il faut demander une imagerie par résonance magnétique (IRM) du système nerveux central.
Le traitement
Il est recommandé de consulter un infectiologue pédiatre ou un spécialiste de la médecine tropicale avant d’amorcer le traitement.
Le praziquantel, qui paralyse et tue les vers en quelques heures, est le traitement recommandé. Les effets indésirables sont généralement légers (nausées transitoires ou malaises). En cas d’infection marquée, le traitement peut entraîner des diarrhées sanglantes ou une hypotension transitoire (29). Le praziquantel est efficace dans plus de 90 % des cas, mais les infections graves peuvent exiger la reprise du traitement. L’innocuité du praziquantel n’est pas établie chez les enfants de moins de cinq ans, mais des données récentes laissent supposer qu’il est sécuritaire et bien toléré (33).
Pour traiter la neuroschistosomiase, le praziquantel doit être combiné à des corticostéroïdes et (peut-être) à des anticonvulsivants, afin d’éviter des exacerbations aiguës après le décès des vers ectopiques (31).
Voir le tableau 3 pour en savoir plus sur le traitement. Il est à souligner que de plus fortes doses de praziquantel doivent être administrées en cas d’infection à Schistosoma japonicum ou à S. mekongi.
Les douves d’origine alimentaire
Chaque année, on estime que les douves d’origine alimentaire provoquent plus de 200 000 maladies, 7 000 décès et plus de deux millions d’années de vie ajustées en fonction de l’incapacité dans le monde (34). L’Asie du Sud-Est et l’Amérique du Sud sont les régions les plus touchées.
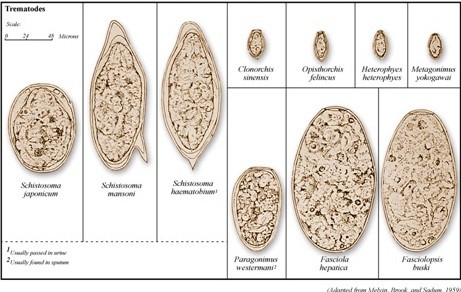
Figure 8. Œufs de trématode observés dans des prélèvements de selle humaine |
|
|
|
|
|
Source : Centers for Disease Control and Prevention, Public Health Image Library |
|
|
Tableau 3. Traitements suggérés en cas d’infection par des douves (trématodes) (16) |
|
Parasite intestinal |
Traitement suggéré pour les enfants et les adolescents |
|
Douve |
|
|
Douve du foie du mouton |
|
Douve des poumons
|
|
|
Schistosomiase (bilharziose) |
|
|
* Non homologué au Canada, mais disponible par l’entremise du Programme d’accès spécial de Santé Canada |
|
Les principales douves d’origine alimentaire (trématodes) qui infectent les humains sont les douves du foie (Opisthorchis, Clonorchis, Fasciola hepatica), les douves intestinales (Fasciolopsis buskii) et les douves des poumons (espèces de Paragonimus). Ces organismes ont tendance à provoquer des infections chroniques dans des populations particulières, en fonction de leur consommation alimentaire de certains types de poisson cru (Clonorchis, Opisthorchis), de crustacés (Paragonimus) ou de plantes aquatiques (F. hepatica, F. buskii) contaminés lors du stade infectieux. L’infection peut être asymptomatique ou provoquer une atteinte aiguë ou chronique qui se manifeste par des douleurs abdominales, une toux, une anorexie, une perte de poids, une urticaire, une anémie ou une éosinophilie. À long terme, les espèces d’Opisthorchis et le Clonorchis sont associées à une fibrose hépatique et à l’apparition d’un cholangiocarcinome (29).
Le pilier du diagnostic demeure la détection d’O et P dans les selles. D’autres tests incluent les dosages sérologiques, l’imagerie, l’O et P dans les expectorations ou les biopsies ou la visualisation de vers adultes pendant des interventions. Les traitements sont énumérés au tableau 3.
C. Les ténias (cestodes)
Le ténia du poisson Diphyllobothrium latum peut être contracté à partir de poisson mal cuit contenant des larves enkystées. Le ténia nain Hymenolepsis nana se transmet entre humains. Les infections par le ténia du bœuf (Taenia saginata) et du porc (Taenia solium) sont présentées ailleurs dans le présent site (La cysticercose et la téniase).
La plupart des infections sont asymptomatiques, mais des infections marquées peuvent être associées à des malaises abdominaux, à la diarrhée, à la fatigue, à l’anémie ou à l’éosinophilie. Le D. latum peut se manifester par une carence en vitamine B12 et en folates (35). L’Hymenolepsis nana peut se manifester par un prurit anal qui imite les infections à oxyure (36). De multiples prélèvements de selle doivent faire l’objet d’une évaluation microscopique pour déceler des œufs ou des proglottis. Voir le tableau 4 pour obtenir de l’information au sujet du traitement.
|
Tableau 4. Traitements suggérés en cas d’infection par les ténias (cestodes) (16) |
|
|---|---|
Parasite intestinal |
Traitement suggéré pour les enfants et les adolescents |
|
Ténias |
|
H. nana (ténia nain) |
|
|
Cysticercose – voir également La cysticercose et la téniase |
|
|
Kyste hydatide (espèces d’Echinococcus) |
|
|
*Voir la référence 22. La niclosamide (fabriquée par Bayer Pharmaceuticals, Finlande) n’est pas homologuée au Canada. Le Programme d’accès spécial de Santé Canada évalue chaque demande. |
|
Le dépistage des helminthes chez les patients asymptomatiques
Il peut être intéressant de dépister les infections à Strongyloides et à Schistosoma chez les nouveaux arrivants asymptomatiques qui arrivent de régions endémiques, puisqu’il s’agit d’infections chroniques qui comportent des risques importants pour la santé. Le traitement de l’infection à Strongyloides subclinique peut éviter l’apparition de symptômes chroniques et d’une maladie disséminée. Le traitement de la schistosomiase est plus efficace au stade précoce, lorsque la pathologie est de nature inflammatoire; la fibrose hépatique avancée ou la néphropathie grave peut être irréversible (28).
La Collaboration canadienne pour la santé des immigrants et des réfugiés recommandes une sérologie du Strongyloides chez tous les réfugiés nouveaux arrivants d’Asie du Sud et d’Afrique, et une sérologie du Schistosoma chez les réfugiés d’Afrique (qui forment les populations les plus à risque) (37). D’autres experts recommandent une sérologie du Strongyloides et du Schistosoma pour tous les nouveaux arrivants des régions endémiques (23, 32). Les personnes susceptibles d’avoir été exposées au Strongyloides, même si le risque est minime, devraient faire l’objet d’un dépistage avant d’entreprendre un traitement immunosuppresseur. Une éosinophilie inexpliquée (>500/mL) chez un nouvel arrivant devrait entraîner le dépistage rapide du Strongyloides, du Schistosoma ou d’autres helminthes, en fonction de l’histoire d’exposition (17).
Conclusion
Le dépistage approprié, de même que le diagnostic et le traitement rapides des parasites gastro-intestinaux chez les jeunes nouveaux arrivants au Canada peuvent contribuer à réduire la morbidité et à prévenir les complications. Une consultation auprès d’un infectiologue pédiatre ou d’un spécialiste des maladies tropicales peut contribuer à orienter les évaluations microbiologiques, à présenter une demande de médicaments antiparasitaires restreints auprès du Programme d’accès spécial de Santé Canada, à prescrire des médicaments antiparasitaires dans divers groupes d’âge et chez des personnes susceptibles d’être co-infectées par de multiples parasites et à surveiller les évènements indésirables.
Remerciements
La Société canadienne de pédiatrie remercie la docteure Laura Erdman de l’Université McMaster pour sa révision approfondie du présent document.
Ressources sélectionnées
- Palazzi, DL, éd. Nelson’s Pediatric Antimicrobial Therapy, 31e éd. Elk Grove Village, IL: American Academy of Pediatrics, 2025.
- Centers for Disease Control and Prevention (États-Unis)
- Organisation mondiale de la Santé
Références
- American Academy of Pediatrics. Giardia duodenalis infections. In: Kimberlin DW, Banerjee R, Barnett ED et coll., éd. Red Book: 2024–2027 Report of the Committee on Infectious Diseases. 33e éd. Elk Grove Village (IL): American Academy of Pediatrics; 2024. p. 390–393.
- Mmbaga BT, Houpt ER. Cryptosporidium and Giardia infections in children: a review. Pediatr Clin North Am Août 2017;64(4):837-50. doi : 10.1016/j.pcl.2017.03.014.
- Helmy YA; Hafez HM. Cryptosporidiosis: from prevention to treatment, a narrative review. Microorganisms 2022;10:2456.
- American Academy of Pediatrics. Cryptosporidiosis. In: Kimberlin DW, Banerjee R, Barnett ED et coll., éd. Red Book: 2024–2027 Report of the Committee on Infectious Diseases 33rd ed. Elk Grove Village (IL): American Academy of Pediatrics; 2024. p. 338–340.
- White AC. Cryptosporidiosis. In: Bennett JE, Dolin R, Blaser MJ, éd. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases, 9th ed. Philadelphia (PA): Elsevier; 2020. p. 3410–3420.
- Lozano R, Naghavi M, Foreman K et coll.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380(9859):2095–2128.
- American Academy of Pediatrics. Amebiasis. In: Kimberlin DW, Banerjee R, Barnett ED et coll., éd. Red Book: 2024–2027 Report of the Committee on Infectious Diseases. 33rd ed. Elk Grove Village (IL): American Academy of Pediatrics; 2024. p. 225–228.
- Staat MA, Rice M, Donauer S et coll. Intestinal parasite screening in internationally adopted children: importance of multiple stool specimens. Pediatrics. 2011;128(3):e613–e622.
- Verweij JJ, Stensvold RC. Molecular testing for clinical diagnosis and epidemiological investigations of intestinal parasitic infections. Clin Microbiol Rev. 2014 Avril;27(2):371–418.
- Petri WA Jr, Haque R, Moonah SN. Entamoeba Species, including amebic colitis and liver abscess. In: Bennett JE, Dolin R, Blaser MJ, éd. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases, 9th ed. Philadelphia (PA): Elsevier; 2020. p. 3273–3286.
- Mørch K, Hanevik K. Giardiasis treatment: an update with a focus on refractory disease. Curr Opin Infect Dis. 2020 Oct;33(5):355–364.
- Meneses C, Chilton L, Duffee J. Immigrant Health Toolkit. American Academy of Pediatrics. Repéré le 20 juin 2025.
- Jones VF, Schulte EE, conseil des soins en foyer d’accueil, de l’adoption et par la famille élargie. Comprehensive health evaluation of the newly adopted child. Pediatrics 2019;143(5):e20190657.
- Pottie K, Greenaway C, Feightner J et coll. Evidence-based clinical guidelines for immigrants and refugees. CMAJ. 2011 Sep 6;183(12):E824–E925. doi:10.1503/cmaj.090313
- Shirley DT, Farr L, Watanabe K et coll. A review of the global burden, new diagnostics, and current therapeutics for amebiasis. Open Forum Infect Dis. 2018 Jul 5;5(7):ofy161.
- American Academy of Pediatrics. Drugs for parasitic infections. In: Kimberlin DW, Banerjee R, Barnett ED et coll., éd. Red Book: 2024–2027 report of the Committee on Infectious Diseases 33e éd. Elk Grove Village (IL): American Academy of Pediatrics; 2024. p. 1068–1112.
- Centers for Disease Control and Prevention des États-Unis. Immigrant and Refugee Health. “Intestinal Parasites.” Repéré le 2 juin 2025.
- Buonfrate D et coll. The Global Prevalence of Strongyloides stercoralis Infection. Pathogens. 2020 juin 13;9(6):468.
- Asundi A et coll. Prevalence of strongyloidiasis and schistosomiasis among migrants: a systematic review and meta-analysis. Lancet Glob Health Février 2019;7(2):e236-48.
- American Academy of Pediatrics. Strongyloidiasis (Strongyloides stercoralis). In: Kimberlin DW, Banerjee R, Barnett ED et coll., éd. Red Book: 2024–2027 Report of the Committee on Infectious Diseases 33rd ed. Elk Grove Village (IL): American Academy of Pediatrics; 2024. p. 822–825.
- Tamarozzi F, Martello E, Giorli G et coll. Morbidity Associated with Chronic Strongyloides stercoralis Infection: A Systematic Review and Meta-Analysis. Am J Trop Med Hyg. 2019 juin;100(6):1305–1311.
- Geri G, Rabbat A, Mayaux J et coll. Strongyloides stercoralis hyperinfection syndrome: a case series and a review of the literature. Infection. 2015;43:691–698.
- Boggild AK, Libman M, Greenaway C et coll. CATMAT statement on disseminated strongyloidiasis: prevention, assessment and management guidelines. Can Commun Dis Rep. 2016 Jan 7;42(1):12–19.
- Suputtamongkol Y, Premasathian N, Bhumimuang K et coll. Efficacy and safety of single and double doses of ivermectin versus 7-day high dose albendazole for chronic strongyloidiasis. PLoS Negl Trop Dis. 2011 mai 10;5(5):e1044.
- Jittamala P, Monteiro W, Smit MR et coll. A systematic review and an individual patient data meta-analysis of ivermectin use in children weighing less than fifteen kilograms: Is it time to reconsider the current contraindication? PLoS Negl Trop Dis. 2021 mars 17;15(3):e0009144.
- Organisation mondiale de la Santé. Schistosomiase. Repéré le 5 mai 2025.
- Montresor A, Mwinzi P, Mupfasoni D, Garba A. Reduction in DALYs lost due to soil-transmitted helminthiases and schistosomiasis from 2000 to 2019 is parallel to the increase in coverage of the global control programmes. PLoS Negl Trop Dis. 2022;16(7):e0010575.
- McManus DP, Dunne DW, Sacko M et coll. Schistosomiasis. Nat Rev Dis Primers. 9 août 2018;4(1):13.
- Maguire, JH. Trematodes (schistosomes and liver, intestinal, and lung flukes). In: Bennett JE, Dolin R, Blaser MJ, éd. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases, 9th ed. Philadelphia (PA): Elsevier; 2020. p. 3451–3462.
- King CH, Dickman K, Tisch DJ. Reassessment of the cost of chronic helmintic infection: a meta-analysis of disability-related outcomes in endemic schistosomiasis. Lancet. 2005;365(9470):1561-9.
- American Academy of Pediatrics. Schistosomiasis. In: Pickering LK, Baker CJ, Kimberlin DW, et coll., éd. Red Book: 2024–2027 Report of the Committee on Infectious Diseases 33rd ed. Elk Grove Village (IL): American Academy of Pediatrics; 2024. p. 753–756.
- Makhani L, Kopalakrishnan S, Bhasker S et coll. Five key points about intestinal schistosomiasis for the migrant health practitioner. Travel Med Infect Dis. mars-avril 2021;40:101971.
- Mutapi F, Rujeni N, Bourke C, Mitchell K, Appleby L et coll. Schistosoma haematobium treatment in 1–5-year-old Children: safety and efficacy of the antihelminthic drug praziquantel. PLoS Negl Trop Dis. 2011;5(5):e1143.
- Organisation mondiale de la Santé. WHO estimates of the global burden of foodborne diseases: foodborne disease burden epidemiology reference group 2007-2015. 2015. Consulté le 3 juin 2025.
- Fairley JK, King CH. Tapeworms (Cestodes). In: Bennett JE, Dolin R, Blaser MJ, éd. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 9th ed. Philadelphia (PA): Elsevier; 2020. p. 3463–3472.
- American Academy of Pediatrics. Other tapeworm infections. In: Kimberlin DW, Banerjee R, Barnett ED et coll., éd. Red Book: 2024–2027 Report of the Committee on Infectious Diseases 33rd ed. Elk Grove Village (IL): American Academy of Pediatrics; 2024. p. 845–848.
- Khan K, Heidebrecht C, Sears J et coll. Appendix 8: Intestinal parasites – Strongyloides and Schistosoma: evidence review for newly arriving immigrants and refugees. Appendix to Pottie K, Greenaway C, Feightner J et coll. Evidence-based clinical guidelines for immigrants and refugees. CMAJ. 2011 Sep 6;183(12):E824–E925. doi:10.1503/cmaj.090313.
Réviseuse scientifique
Laura Erdman, MD
Mise à jour : octobre, 2025