La cysticercose et la téniase
Faits saillants
- La téniase est une infection intestinale causée par le ténia adulte, c’est-à-dire le Taenia saginata (chez les bovins), le Taenia solium ou le Tania asiatica (tous deux chez les porcins), également connus sous le nom de ver solitaire. Chez les personnes infectées, les symptômes sont souvent légers ou inexistants. Une dose d’antiparasitaire par voie orale est très efficace pour éradiquer le parasite.
- L’infection à T solium peut entraîner la cysticercose, une infection tissulaire par le stade larvaire (ou cysticerque) de ce ténia.
- Les humains sont les hôtes définitifs des trois espèces de ténias. Les œufs libérés dans les excréments humains contaminent le sol et infectent les porcins et les bovins. La cysticercose porcine est très endémique en Amérique latine, en Afrique subsaharienne et en Asie du Sud et du Sud-Est. Le T asiatica sévit seulement en Asie.
- La neurocysticercose est la forme la plus grave de la cysticercose. Elle est attribuable à des kystes du système nerveux central et constitue une cause importante d’épilepsie (apparition à l’âge adulte et, moins souvent, pendant l’enfance) dans les régions endémiques. Les convulsions, les céphalées et l’hydrocéphalie en sont les manifestations les plus courantes.
- Les cas de neurocysticercose se répandent en Europe, aux États-Unis et au Canada en raison de l’intensification de la migration et des voyages.
- Les dispensateurs de soins devraient connaître les symptômes, le diagnostic et le traitement de cette infection au potentiel grave.
- Il est recommandé de consulter des spécialistes de l’infectiologie, de la neurologie et de l’ophtalmologie avant d’administrer un antiparasitaire.
La téniase : Introduction
La téniase est attribuable à une infection intestinale par le ténia adulte, le Taenia saginata (chez les bovins) ou le Taenia solium (chez les porcins). En Asie, c’est le Taenia asiatica qui en est responsable. Le T solium prend deux formes distinctes chez l’hôte humain :
- Téniase : Infection de la lumière intestinale par le ténia
- Cysticercose : Infection des tissus par les kystes larvaires (cysticerques)
Le ténia : le cycle de vie
Figure 1. Le cycle de vie du ténia
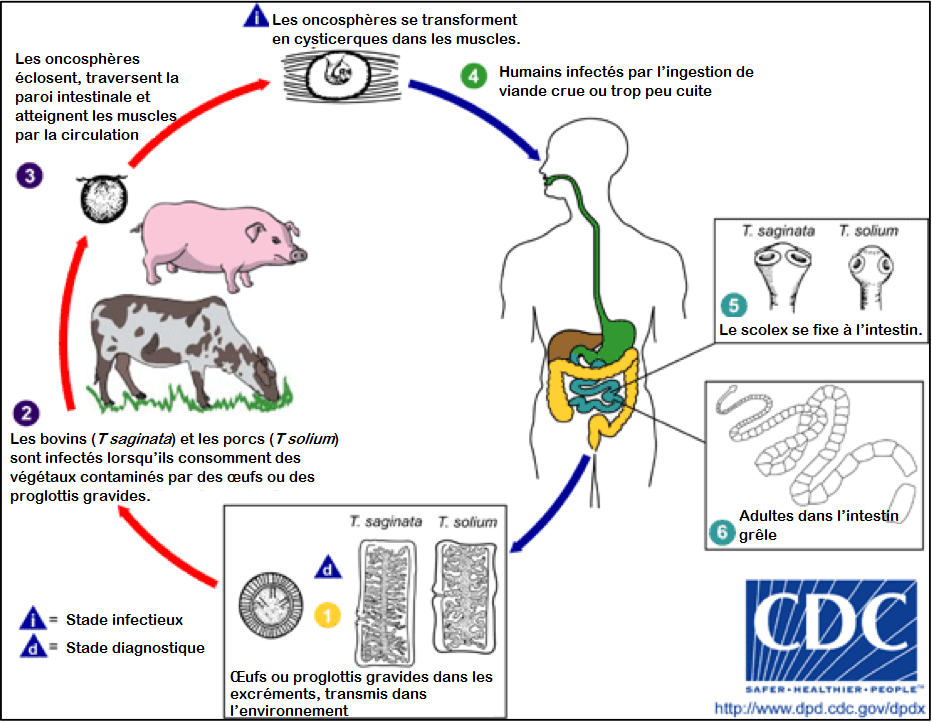
Source : Centers for Disease Control and Prevention. DPDx: Taeniasis. www.cdc.gov/dpdx/taeniasis/index.html
La téniase est contractée par l’ingestion de cysticerques contenus dans du porc (T solium) ou du bœuf (T saginata) mal cuit. Le cysticerque peut se développer en ver adulte, vivre dans l’intestin et, s’il n’est pas traité, atteindre une longueur de deux à huit mètres. De six à huit semaines après l’ingestion, des symptômes gastro-intestinaux peuvent se manifester, tels que des nausées, de la diarrhée ou de la constipation et des douleurs abdominales, mais de nombreux patients demeurent asymptomatiques.
Le ténia adulte libère des proglottis (segments) porteurs d’œufs semblables à un ruban élastique blanc qui ressort de l’anus, qui migre de l’anus ou qui est contenu dans les excréments. Non traité, un ténia peut vivre et produire des proglottis pendant des décennies.1
Figure 2. Le ténia adulte
Adultes Taenia spp. Les adultes peuvent atteindre une longueur de deux à huit mètres, mais le scolex a un diamètre de seulement un à deux millimètres.
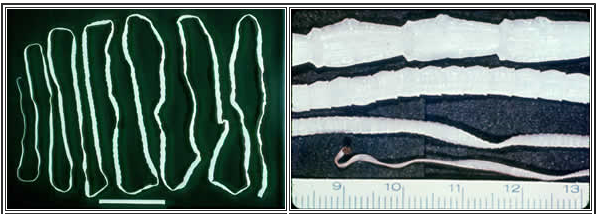
Source : Centers for Disease Control and Prevention. DPDx: Taeniasis. www.cdc.gov/dpdx/taeniasis/gallery.html
Figure 3. Les œufs du T solium et du T saginata ont la même apparence
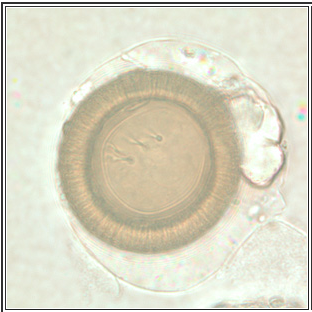
Source: Centers for Disease Control and Prevention. DPDx: Taeniasis. www.cdc.gov/dpdx/taeniasis/gallery.html
La téniase: le diagnostic
Le diagnostic de téniase (l’infection par le ténia adulte) dépend de la présence de proglottis ou d’œufs dans les excréments ou la région périanale. Puisque les œufs et les proglottis se détachent de manière intermittente, la sensibilité de la microscopie des excréments n’est que de 26 % pour déceler les œufs. Le rendement s’améliore si trois coprocultures sont recueillies trois jours différents. Les œufs du T solium et du T saginata sont impossibles à distinguer au microscope. Pour déterminer l’espèce du parasite, il faut examiner les diverses structures des proglottis gravides et des scolex.2
La téniase : le traitement
Le traitement au praziquantel par voie orale est très efficace pour éradiquer l’infection par le ténia adulte. Une dose unique de 5 mg/kg à 10 mg/kg doit être prise avec des liquides pendant un repas.
La cysticercose : le cycle de vie
Le T solium (des porcins) est plus inquiétant pour la santé publique que le T saginata parce que la transmission d’œufs de ténias entre humains peut provoquer la cysticercose, une grave maladie parasitaire.1
Figure 4. Le cycle de vie de la cysticercose
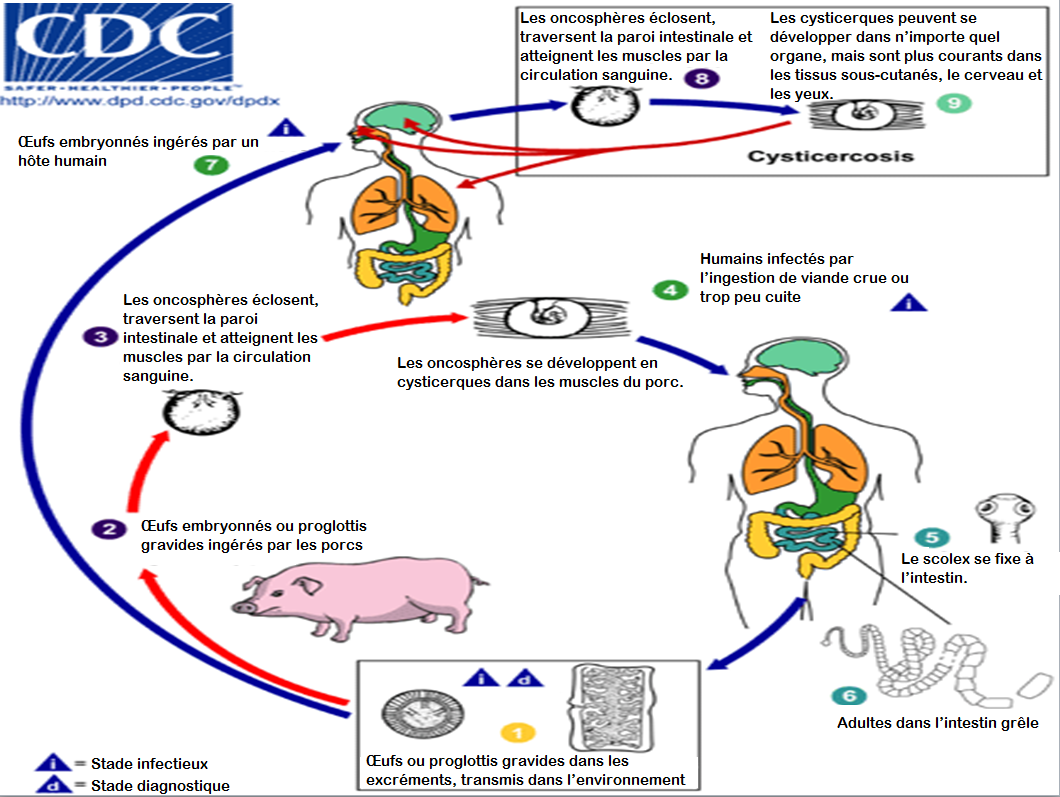
Source : Centers for Disease Control and Prevention. DPDx: Cysticercosis. www.cdc.gov/dpdx/cysticercosis/index.html
La cysticercose : l’acquisition
Les humains contractent la cysticercose en ingérant des œufs du ténia de porc (T solium). Contrairement à la téniase, la cysticercose n’est pas causée par l’ingestion de viande trop peu cuite. Les œufs se trouvent uniquement dans les excréments d’un humain infecté par le ténia, qui peut transmettre l’infection à d’autres (ou à des porcs) par la contamination de la terre, de l’eau ou des aliments par ses excréments.1 Les cas d’auto-inoculation sont également possibles. Les œufs peuvent vivre jusqu’à deux mois dans l’eau, la terre ou la végétation.3
Une fois ingérés, les œufs éclosent dans l’intestin grêle, et les larves migrent dans divers tissus du corps, où elles forment des kystes. C’est ce qu’on appelle la cysticercose. Si les kystes se fixent dans le cerveau, on parle de neurocysticercose, la forme la plus grave de la maladie.
La cysticercose : l’épidémiologie
La cysticercose est hautement endémique en Amérique latine, en Afrique subsaharienne et en Asie du Sud et du Sud-Est, ainsi que dans des régions de la Corée, de la Chine, de l’Indonésie et de la Papouasie-Nouvelle-Guinée.2 Selon l’Organisation mondiale de la Santé (OMS), de 2,5 à 8,3 millions de personnes sont atteintes de neurocysticercose, symptomatique ou non.
Figure 5. Pays et zones exposés à la cysticercose, 2009
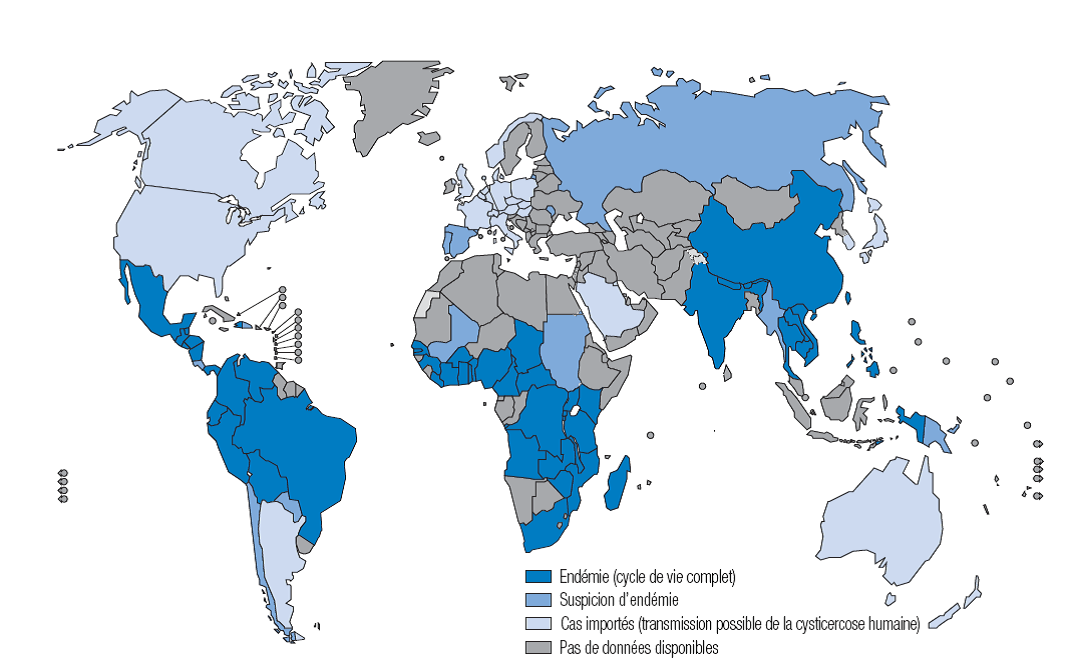
Source : Reproduction autorisée par l’éditeur, tirée de Agir pour réduire l’impact mondial des maladies tropicales négligées : Premier rapport de l’OMS sur les maladies tropicales négligées, 2010. Genève, OMS, 2010. (Consulté le 4 mars 2014)
Dans les pays en développement, la neurocysticercose est une infection courante du système nerveux central (SNC) humain, et la principale cause d’épilepsie évitable. En raison de l’intensification de la migration en provenance de pays endémiques et des voyages plus courants dans ces pays, la neurocysticercose est devenue plus fréquente dans les pays industrialisés.
Aux États-Unis, les cas classiques sont des immigrants d’Amérique latine et d’Asie qui ont été infectés dans leur pays d’origine2 ou qui ont contracté la cysticercose d’un proche aux États-Unis.
Les données sont limitées au Canada. En 2012, Del Brutto a extrait 21 articles faisant état de 60 patients, dont 40 (67 %) avaient été diagnostiqués au cours des deux décennies précédentes. Les immigrants représentaient 96 % des 28 cas pour lesquels la citoyenneté était précisée.4 Il se peut que certains patients aient contracté la maladie au Canada de contacts familiaux porteurs du T solium adulte dans l’intestin.3
Même si la cysticercose est peu fréquente au Canada, les dispensateurs de soins doivent savoir qu’elle peut provoquer des convulsions afébriles chez les enfants et les adolescents.
La cysticercose : les indices cliniques
Le délai entre l’infection et l’apparition des symptômes est variable, et les personnes infectées par la cysticercose peuvent demeurer asymptomatiques pendant des années.
Les manifestations cliniques sont également variables. Elles dépendent du foyer des cysticerques et de la réponse inflammatoire de l’hôte.2
Figure 6. Les lésions de la neurocysticercose dans le cerveau
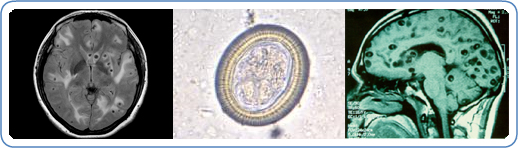
Sources : (de G à D) Westchester Medical Centre; Centers for Disease Control and Prevention, Public Health Image Library (PHIL); Cysticercosis Working Group in Peru. www.cdc.gov/parasites/cysticercosis/index.html
La plupart des symptômes sont causés par une inflammation autour des kystes qui dégénèrent ou qui meurent, mais les kystes calcifiés (morts) peuvent constituer le foyer d’origine des convulsions, tandis que les kystes viables (vivants) en expansion peuvent provoquer des symptômes attribuables à l’effet de masse. Les signes et symptômes sont énumérés au tableau 1 et décrits plus loin.
| Plus courants | Moins courants |
|
|
La plupart des consultations médicales, et celles qui s’associent aux problèmes les plus graves, découlent d’une infection dont le siège se situe dans le cerveau. Certains patients, y compris des enfants, présentent un seul symptôme : des céphalées violentes (évocatrices d’une céphalée de tension ou d’une migraine).2
De 70 % à 90 % des patients symptomatiques ont des crises d’épilepsie. En général, ces crises se manifestent entre l’âge de cinq et 40 ans, mais on a déjà signalé des convulsions chez des nourrissons. D’ordinaire, les convulsions sont d’origine focale et se généralisent, mais elles peuvent également être focales ou généralisées.2
La neurocysticercose peut s’associer à des signes et symptômes d’augmentation de la pression intracrânienne et d’altération de l’état mental. L’encéphalite à cysticerque désigne un œdème cérébral diffus imputable à de multiples cysticerques enflammés.2 L’hypertension intracrânienne, la présence de gros kystes basilaires ou sus-tentoriels, une multitude de kystes ou un accident ischémique cérébral sont tous des symptômes au potentiel mortel.5
L’hydrocéphalie obstructive, la méningite chronique, les anomalies des nerfs crâniens et les troubles du comportement font partie des manifestations moins fréquentes. Les enfants infectés peuvent acquérir des troubles d’apprentissage.
Les kystes de la colonne vertébrale peuvent être responsables de troubles de la démarche, de douleurs ou d’une myélite transverse.
Les cysticerques sous-cutanées produisent des lésions kystiques mobiles palpables, mais indolores, qui se résorbent au bout de quelques mois à quelques années.6 La maladie sous-cutanée est plus fréquente en Asie et en Afrique qu’en Occident2. L’atteinte musculosquelettique peut entraîner une pseudohypertrophie, une faiblesse accompagnée d’une infection massive ou des calcifications fusiformes visibles à la radiographie, même sans symptômes musculosquelettiques.6 L’atteinte oculaire, qui touche surtout la rétine ou le vitré, peut réduire l’acuité visuelle ou provoquer d’autres troubles du champ visuel.7
Un patient qui est l’hôte de multiples cysticerques peut présenter simultanément plusieurs manifestations cliniques (p. ex., lésions du parenchyme cérébral responsables de convulsions, kystes intraventriculaires responsables d’une hydrocéphalie, lésions médullaires, lésions oculaires).
La cysticercose : le diagnostic
La neurocysticercose est plus difficile à diagnostiquer que bien d’autres infections parasitaires, parce que les excréments du patient ne contiennent pas nécessairement les œufs du parasite et que les manifestations cliniques ne sont pas spécifiques. Les lésions prenant le contraste lors des études de neuro-imagerie sont représentatives de la neurocysticercose, mais la tuberculose, les abcès cérébraux et les tumeurs peuvent produire des lésions similaires.2
Envisagez un diagnostic de neurocysticercose si votre patient :3
- a un contact familial atteint de l’infection à T solium;
- provient d’une région où la cysticercose est endémique;
- voyage régulièrement dans une région où la maladie est endémique;
- présente des convulsions de novo;
- présente des lésions kystiques, des lésions solitaires qui prennent le contraste ou des calcifications ponctuées visibles lors des études de neuro-imagerie;
- a des lésions kystiques intracrâniennes qui se résorbent après un traitement à l’albendazole ou au praziquantel.
La biopsie des kystes sous-cutanés, l’immunodiagnostic (la recherche d’anticorps ou d’antigènes des parasites dans des prélèvements sériques), et l’imagerie (radiographie, tomodensitométrie et imagerie par résonance magnétique [IRM]) font partie des tests utilisés pour déceler la cysticercose.1
Pour poser un diagnostic de neurocysticercose, il faut généralement procéder à la fois à une imagerie du SNC et à des tests sérologiques. Il faut toujours obtenir une anamnèse détaillée, axée sur la résidence ou des voyages prolongés dans des pays endémiques, de même que sur la consommation d’aliments préparés par une personne qui a habité dans une région à haut risque.8 Des conseils sur la prise d’antécédents auprès des familles de nouveaux arrivants, y compris le recours à des interprètes, sont offerts dans le présent site Web.
L’imagerie du SNC par tomodensitométrie ou IRM peut avoir une valeur diagnostique si un scolex (le rostre ou l’organe fixateur, qui peut avoir l’apparence d’un point sur un trou) est perçu sur l’image.9 La réaction inflammatoire à la dégénérescence des kystes et l’œdème qui en découle forment un anneau qui prend le contraste autour du kyste. Chez les enfants, les lésions se trouvent généralement dans le cortex.2
Des examens sérologiques sont nécessaires pour confirmer le diagnostic lorsque la neuro-imagerie évoque la possibilité de neurocysticercose. Les titrages d’anticorps qui décèlent un anticorps spécifique au T solium larvaire dans le sérum et le liquide céphalorachidien (LCR) sont les tests de première intention. Il est possible de faire effectuer une épreuve d’immunodosage par le Centre national de référence en parasitologie (CNRP) du Centre J.D MacLKean pour les maladies tropicales à Montréal (www.mcgill.ca/tropmed/services/national-reference-centre-parasitology/immunodiagnostic-service). Les tests sérologiques sont moins utiles en présence d’une lésion solitaire, un résultat plus courant chez les enfants et chez les personnes originaires du sous-continent indien.5
Il est rare de voir un parasite pendant l’examen ophtalmologique ou dans un prélèvement de tissu, mais c’est un diagnostic définitif de neurocysticercose.2
La cysticercose : le traitement
Il est possible d’être infecté à la fois par le ténia T solium (téniase) et par la cysticercose, et la cysticercose peut représenter un spectre de maladies dont la prise en charge optimale est différente.2 L’approche thérapeutique dépend du siège, du nombre et du stade des cysticerques, de même que des manifestations cliniques (particulièrement en présence d’une encéphalopathie ou d’une hydrocéphalie).
Il n’est pas urgent de commencer la chimiothérapie anthelmintique. On peut la planifier tout en axant les soins médicaux initiaux sur le contrôle des symptômes (p. ex., amorcer les anticonvulsivants ou l’intervention neurochirurgicale pour traiter l’hydrocéphalie).5
Puisque la thérapie antiparasitaire peut susciter des effets secondaires au potentiel mortel, il est essentiel de consulter un infectiologue, un neurologue et un ophtalmologiste (pour écarter l’éventualité de cysticerques intraoculaires) avant de l’entreprendre.
Deux médicaments antiparasitaires, l’albendazole et le praziquantel, endommagent le parasite.3 L’inflammation périlésionnelle qui en découle peut d’abord aggraver l’état du patient ou même le tuer, selon le siège des kystes viables.5
Selon les études, l’albendazole réduit le nombre de cysticerques vivants avec plus d’efficacité que le praziquantel. Il a l’avantage de mieux pénétrer dans le liquide céphalorachidien (LCR), d’accroître les taux de sérum et de LCR lorsqu’il est administré avec de la dexaméthasone et de causer moins d’interactions avec les anticonvulsivants. La dexaméthasone, la phénytoïne et la carbamazépine peuvent réduire les effets du praziquantel.10
D’ordinaire, l’albendazole est administré à une dose de 15 mg/kg/jour fractionnés en deux doses par voie orale (maximum de 800 mg/jour) pendant deux semaines, mais la durée du traitement varie en fonction du nombre et du siège des kystes. On commence par administrer des stéroïdes et des anticonvulsivants, puis on contrôle les symptômes avant d’entreprendre le traitement antiparasitaire. Le traitement aux stéroïdes est généralement d’une durée de une à deux semaines, réduit progressivement.11
Les kystes intraventriculaires sont généralement soignés par exérèse chirurgicale, de préférence par endoscopie. Les anthelmintiques sont relativement contre-indiqués, parce que la réponse inflammatoire qui en découle peut précipiter une hydrocéphalie obstructive. Si les cysticerques ne peuvent être extraits facilement, il faut corriger l’hydrocéphalie par des shunts intraventriculaires. La chimiothérapie d’appoint au moyen d’un antiparasitaire et de corticoïdes peut réduire le taux d’échec subséquent des shunts.2
La cysticercose de l’œil, de la colonne vertébrale ou des tissus sous-cutanés se soigne généralement par l’exérèse chirurgicale des cysticerques. Il ne faut pas utiliser d’albendazole ou de praziquantel pour traiter les kystes oculaires ou spinaux, même en conjonction avec les corticoïdes. En effet, l’inflammation risque de causer des dommages permanents.
Les convulsions peuvent réapparaître pendant des mois ou des années. La décision de mettre un terme à un traitement anticonvulsivant dépend de chaque cas. Cependant, la thérapie anticonvulsivante est généralement recommandée jusqu’à l’arrêt des convulsions pendant au moins deux ans. Les facteurs de risque de récurrence des convulsions sont l’épilepsie, un mauvais contrôle des convulsions pendant le traitement et des changements persistants à la radiographie et à l’électroencéphalographie.12
La cysticercose : le pronostic
On ne connaît pas la proportion de patients qui se rétablissent pleinement de la cysticercose, avec ou sans traitement.1
Le pronostic de la neurocysticercose est d’une extrême variabilité. Les patients symptomatiques qui présentent des lésions uniques s’en tirent généralement bien, souvent sans convulsions, et peuvent arrêter les anticonvulsivants au bout de un ou deux ans. Les patients présentant de nombreux cysticerques dans les espaces sous-arachnoïdiens ont souvent besoin de plusieurs traitements et de multiples opérations.2 Le taux de mortalité est faible chez les patients ayant des kystes parenchymateux sans hydrocéphalie.
La cysticercose : la prévention
Il est essentiel de prévenir la transmission des œufs d’une personne à l’autre pour contrôler la maladie. Quelques mesures pratiques sont de mise :
- Le dépistage et le traitement des porteurs de ténias sont d’importantes mesures de santé publique qui peuvent prévenir les futurs cas d’infection.8
- Il faut dépister et traiter les personnes atteintes de téniase.
- Il faut faire passer des tests de dépistage aux personnes ayant la cysticercose et à leurs contacts familiaux afin de déceler la téniase.
- Les personnes qui préparent les aliments peuvent réduire le risque de transmission de maladies entériques, y compris la neurocysticercose, en adoptant de bonnes pratiques de lavage des mains.
- Les personnes qui se rendent dans des régions où les conditions d’hygiène laissent à désirer devraient s’assurer de ne pas consommer d’aliments susceptibles d’être contaminés par des excréments humains, tels que les légumes crus et les fruits qui ne peuvent pas être pelés.
La mise au point d’un vaccin efficace contre la cysticercose pourrait représenter le meilleur outil potentiel pour éradiquer la maladie.13
Références
- OMS. Neglected tropical diseases: Cysticercosis/Taeniasis. www.who.int/neglected_diseases/diseases/cysticercosis/en/index.html
- Cherry J, Demmler-Harrison GJ et coll. (éd.) Feigin and Cherry’s Textbook of Paediatric Infectious Diseases, 7e éd. Elsevier/Saunders, 2014:3030-40.
- Burneo JG, Plener I, Garcia HH. Neurocysticercosis in a patient in Canada. CMAJ 2009; 180(6):639-42.
- Del Brutto OH. A review of cases of human cysticercosis in Canada. Can J Neurol Sci 2012; 39(3):319-22.
- Krilov LR, Cantey PT, Burke AP. Cysticercosis among parasitic infections targeted by CDC. AAP News 2012;33(10):20.
- Agence de la santé publique du Canada. Taenia solium – Fiche technique santé-sécurité : agents pathogènes – Agents infectieux. www.phac-aspc.gc.ca/lab-bio/res/psds-ftss/taenia-solium-fra.php
- Garcia HH, Del Brutto OH; Cysticercosis Working Group in Peru. Neurocysticercosis: Updated concepts about an old disease. Lancet Neurol 2005;4(10):653-61.
- Centers for Disease Control and Prevention – Parasites – Cysticercosis: Resources for Health Professionals. www.cdc.gov/parasites/cysticercosis/health_professionals/index.html
- Del Brutto OH. Neurocysticercosis: A review. Sci World J 2012;159821, doi:10.1100/2012/159821
- Bayer Inc. Monographie de produit : prBiltricide ® (praziquantel) comprimés à 600 mg – Anthelminthique. Bayer inc., 9 mai 2017.
- Garcia HH, Nash TE, Del Brutto OH. Clinical symptoms, diagnosis, and treatment of neurocysticercosis. Lancet Neurol. 2014 Dec;13(12):1202-15.
- Bustos JA, Garcia HH, Del Brutto OH. Antiepileptic drug therapy and recommendations for withdrawal in patients with seizures and epilepsy due to neurocysticercosis. Expert Rev Neurother. 2016 Sep;16(9):1079-85.
- Nash TE, Mahanty S, Garcia HH. Neurocysticercosis – More than a neglected disease. PLoS Negl Trop Dis 2013;7(4):e1964.
Réviseuse scientifique
Heather Onyett, MD
Mise à jour : août, 2020
